Membedah Kisi-Kisi Soal Kimia Kelas X KD 3.4: Menguasai Konsep Stoikiometri untuk Masa Depan
Kimia, sebagai ilmu yang mempelajari materi dan perubahannya, memegang peranan krusial dalam memahami berbagai fenomena alam dan pengembangan teknologi. Di jenjang Sekolah Menengah Atas (SMA), pemahaman mendalam terhadap konsep-konsep kimia menjadi fondasi penting bagi siswa untuk melanjutkan studi ke jenjang yang lebih tinggi maupun memasuki dunia kerja. Salah satu Kompetensi Dasar (KD) yang menjadi kunci dalam kurikulum Kimia Kelas X adalah KD 3.4, yang berfokus pada Stoikiometri.
Stoikiometri, secara sederhana, adalah studi kuantitatif tentang reaktan dan produk dalam reaksi kimia. Ini adalah cabang kimia yang sangat fundamental, karena memungkinkan kita untuk menghitung jumlah zat yang bereaksi dan dihasilkan dalam suatu reaksi. Memahami stoikiometri tidak hanya penting untuk menjawab soal ujian, tetapi juga untuk mengaplikasikan prinsip-prinsip kimia dalam kehidupan sehari-hari, mulai dari menghitung dosis obat, formulasi bahan makanan, hingga proses industri berskala besar.
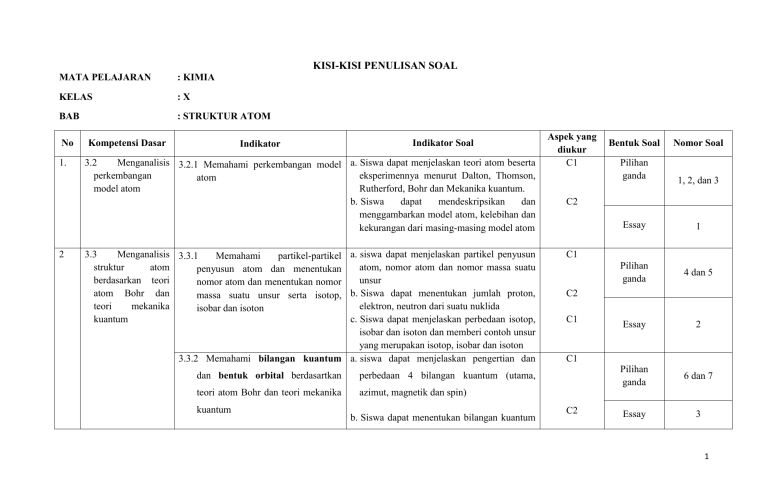
Oleh karena itu, pada kesempatan ini, kita akan membedah secara mendalam kisi-kisi soal Kimia Kelas X KD 3.4. Artikel ini akan menguraikan cakupan materi, tingkat kesulitan soal, jenis-jenis soal yang mungkin muncul, serta strategi efektif untuk mempersiapkan diri menghadapi evaluasi. Dengan pemahaman yang komprehensif terhadap kisi-kisi ini, diharapkan siswa dapat lebih percaya diri dan berhasil menguasai konsep stoikiometri.
Cakupan Materi dalam KD 3.4 Stoikiometri
KD 3.4 umumnya mencakup beberapa sub-topik penting yang saling berkaitan. Berikut adalah rincian materi yang sering kali menjadi fokus dalam penyusunan soal:
-
Konsep Mol dan Hubungannya dengan Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr):
- Pengertian Mol: Ini adalah unit dasar dalam stoikiometri yang mewakili jumlah partikel (atom, molekul, ion) sebanyak bilangan Avogadro (6,02 x 10^23).
- Bilangan Avogadro: Penting untuk dipahami sebagai faktor konversi antara jumlah partikel dan mol.
- Massa Atom Relatif (Ar): Massa rata-rata atom suatu unsur relatif terhadap 1/12 massa atom karbon-12. Data ini biasanya tersedia dalam tabel periodik.
- Massa Molekul Relatif (Mr): Jumlah Ar dari atom-atom penyusun suatu molekul.
- Konversi: Siswa harus mampu mengkonversi antara massa zat (dalam gram), jumlah mol, dan jumlah partikel. Soal dapat berupa menghitung massa zat jika diketahui jumlah molnya, atau sebaliknya.
-
Konsep Mol dan Volume Gas pada STP (Standar Temperature and Pressure) dan Kondisi Lain:
- Volume Molar Gas: Pada STP (0°C dan 1 atm), 1 mol gas ideal menempati volume 22,4 L.
- Kondisi Non-STP: Siswa juga perlu memahami bagaimana menghitung volume gas pada suhu dan tekanan yang berbeda dari STP, seringkali menggunakan persamaan gas ideal ($PV = nRT$) atau perbandingan volume gas (Hukum Gay-Lussac).
- Konversi: Menghitung volume gas jika diketahui jumlah molnya, atau sebaliknya.
-
Konsep Mol dan Hubungannya dengan Konsentrasi Larutan (Molaritas):
- Molaritas (M): Jumlah mol zat terlarut per liter larutan. Ini adalah cara umum untuk menyatakan konsentrasi larutan.
- Perhitungan Molaritas: Siswa harus mampu menghitung molaritas larutan jika diketahui massa zat terlarut dan volume larutan, atau menghitung massa zat terlarut yang dibutuhkan untuk membuat larutan dengan molaritas tertentu.
- Pengenceran: Konsep pengenceran larutan, di mana larutan pekat diencerkan dengan penambahan pelarut, juga sering diujikan. Rumus yang digunakan adalah $M_1V_1 = M_2V_2$.
-
Perhitungan Stoikiometri dalam Reaksi Kimia:
- Persamaan Reaksi Setara: Kunci utama dalam stoikiometri reaksi adalah memiliki persamaan reaksi yang sudah setara. Ini memastikan hukum kekekalan massa terpenuhi. Siswa harus mampu menyetarakan persamaan reaksi sederhana.
- Perbandingan Mol (Koefisien Reaksi): Koefisien pada persamaan reaksi setara menunjukkan perbandingan mol antara reaktan dan produk. Ini adalah alat utama untuk melakukan perhitungan stoikiometri.
- Menghitung Jumlah Zat yang Bereaksi dan Dihasilkan: Soal dapat berupa:
- Menghitung massa atau mol produk yang dihasilkan dari sejumlah reaktan.
- Menghitung massa atau mol reaktan yang dibutuhkan untuk menghasilkan sejumlah produk.
- Menghitung massa atau mol reaktan yang dibutuhkan untuk bereaksi sempurna dengan sejumlah reaktan lain.
-
Pereaksi Pembatas (Limiting Reactant):
- Definisi: Pereaksi pembatas adalah reaktan yang habis bereaksi lebih dahulu dalam suatu reaksi kimia, sehingga membatasi jumlah produk yang dapat terbentuk.
- Identifikasi Pereaksi Pembatas: Siswa perlu dapat mengidentifikasi pereaksi pembatas dari jumlah reaktan yang diketahui, biasanya dengan membandingkan rasio mol aktual dengan rasio mol stoikiometris.
- Perhitungan Berdasarkan Pereaksi Pembatas: Setelah pereaksi pembatas diidentifikasi, semua perhitungan jumlah produk yang dihasilkan harus didasarkan pada jumlah pereaksi pembatas tersebut.
-
Persen Rendemen (Percentage Yield):
- Rendemen Teoritis: Jumlah produk maksimum yang dapat dihasilkan berdasarkan perhitungan stoikiometri dari pereaksi pembatas.
- Rendemen Aktual: Jumlah produk yang sebenarnya diperoleh dari percobaan di laboratorium.
- Persen Rendemen: Perbandingan antara rendemen aktual dan rendemen teoritis, dikalikan 100%. Siswa harus mampu menghitung persen rendemen jika diketahui rendemen aktual dan perhitungan stoikiometri, atau sebaliknya.
Tingkat Kesulitan dan Jenis Soal
Kisi-kisi soal biasanya dirancang untuk mengukur berbagai tingkat kemampuan kognitif siswa, mulai dari pemahaman dasar hingga kemampuan analisis dan evaluasi. Untuk KD 3.4, jenis soal yang sering muncul meliputi:
-
Soal Pilihan Ganda: Ini adalah format soal yang paling umum. Pertanyaan dapat bervariasi dari definisi, konsep dasar, hingga soal perhitungan yang membutuhkan beberapa langkah.
- Tingkat Pemahaman (C1-C2): Pertanyaan yang menguji pemahaman definisi, konsep, dan identifikasi. Contoh: "Manakah pernyataan yang benar mengenai mol?" atau "Apa yang dimaksud dengan pereaksi pembatas?"
- Tingkat Penerapan (C3): Soal yang meminta siswa menerapkan konsep stoikiometri dalam perhitungan sederhana. Contoh: "Jika 2 mol gas oksigen bereaksi, berapa gram massa oksigen yang bereaksi?"
- Tingkat Analisis (C4): Soal yang lebih kompleks, seringkali melibatkan pereaksi pembatas, persen rendemen, atau perhitungan yang membutuhkan pemahaman mendalam tentang hubungan antar konsep. Contoh: "Dalam reaksi X + Y -> Z, jika diketahui massa X dan Y yang bereaksi, tentukan pereaksi pembatasnya."
-
Soal Uraian/Esai: Soal jenis ini memungkinkan siswa untuk menunjukkan pemahaman mereka secara lebih mendalam dan menjelaskan langkah-langkah penyelesaian.
- Perhitungan Kompleks: Soal uraian seringkali meminta siswa untuk melakukan serangkaian perhitungan stoikiometri, termasuk identifikasi pereaksi pembatas dan perhitungan persen rendemen.
- Penjelasan Konsep: Siswa mungkin diminta untuk menjelaskan mengapa konsep mol penting dalam kimia, atau menjelaskan bagaimana pereaksi pembatas memengaruhi hasil reaksi.
-
Soal Pasan (Matching): Meskipun kurang umum untuk materi perhitungan, soal pasang dapat digunakan untuk menguji pemahaman istilah atau rumus yang berkaitan dengan stoikiometri.
Contoh Soal Berdasarkan Tingkat Kesulitan:
-
Tingkat Pemahaman:
- Satu mol zat mengandung jumlah partikel sebanyak:
a. 6,02 x 10^23
b. 12,04 x 10^23
c. 1,66 x 10^-24 gram
d. 1 gram
- Satu mol zat mengandung jumlah partikel sebanyak:
-
Tingkat Penerapan:
- Hitung massa 0,5 mol gas CO2 (Ar C = 12, Ar O = 16)!
-
Tingkat Analisis:
- Sebanyak 10 gram magnesium direaksikan dengan 10 gram asam klorida (HCl). Jika diketahui Ar Mg = 24, Ar H = 1, dan Ar Cl = 35,5, tentukan:
a. Pereaksi pembatasnya.
b. Massa magnesium klorida (MgCl2) yang dihasilkan.
c. Massa sisa pereaksi yang tidak bereaksi.
(Persamaan reaksi: Mg(s) + 2HCl(aq) -> MgCl2(aq) + H2(g))
- Sebanyak 10 gram magnesium direaksikan dengan 10 gram asam klorida (HCl). Jika diketahui Ar Mg = 24, Ar H = 1, dan Ar Cl = 35,5, tentukan:
Strategi Efektif Menghadapi Soal Stoikiometri
Menguasai stoikiometri membutuhkan latihan dan pemahaman yang sistematis. Berikut adalah beberapa strategi yang dapat membantu siswa:
- Pahami Konsep Dasar dengan Kuat: Pastikan Anda benar-benar memahami arti mol, bilangan Avogadro, Ar, dan Mr. Tanpa pemahaman dasar ini, perhitungan akan terasa sulit.
- Hafalkan Rumus Kunci, Tapi Pahami Konteksnya: Hafalkan rumus-rumus seperti hubungan mol-massa, mol-partikel, mol-volume gas, dan molaritas. Namun, yang lebih penting adalah memahami kapan dan bagaimana menggunakan setiap rumus tersebut.
- Latihan Menyetarakan Persamaan Reaksi: Ini adalah langkah awal yang krusial. Persamaan reaksi yang tidak setara akan menghasilkan perhitungan yang salah.
- Fokus pada Perbandingan Mol: Ingatlah bahwa koefisien pada persamaan reaksi setara adalah perbandingan mol. Ini adalah jembatan antara satu zat dengan zat lain dalam reaksi.
- Identifikasi Pereaksi Pembatas dengan Cermat: Pelajari berbagai metode untuk mengidentifikasi pereaksi pembatas. Latih diri Anda untuk mengenali mana reaktan yang akan habis lebih dulu.
- Kerjakan Soal Latihan Secara Bertahap: Mulailah dari soal-soal yang lebih sederhana dan secara bertahap tingkatkan kesulitannya. Jangan ragu untuk mengulang soal yang sama jika belum benar-benar dipahami.
- Gunakan Diagram atau Tabel Bantu: Untuk soal yang kompleks, menggambar diagram alur atau membuat tabel yang memuat informasi massa, mol, dan pereaksi dapat sangat membantu dalam memvisualisasikan dan melacak perhitungan.
- Perhatikan Satuan: Selalu perhatikan satuan yang digunakan dalam soal dan pastikan satuan yang Anda gunakan dalam perhitungan konsisten.
- Diskusikan dengan Teman atau Guru: Jika Anda mengalami kesulitan, jangan ragu untuk bertanya kepada guru atau mendiskusikan soal dengan teman. Belajar bersama dapat membuka wawasan baru.
- Manfaatkan Sumber Belajar Tambahan: Baca buku teks, cari video tutorial online, atau gunakan aplikasi edukasi yang relevan dengan stoikiometri.
Kesimpulan
KD 3.4 Stoikiometri merupakan salah satu pilar penting dalam pembelajaran Kimia di kelas X. Penguasaan konsep ini tidak hanya akan membantu siswa meraih hasil yang baik dalam evaluasi, tetapi juga membekali mereka dengan kemampuan analitis dan kuantitatif yang esensial untuk memahami dunia di sekitar mereka. Dengan memahami kisi-kisi soal, menguasai materi secara mendalam, dan menerapkan strategi belajar yang efektif, siswa dapat memecah hambatan dan meraih keberhasilan dalam menguasai stoikiometri. Ingatlah, stoikiometri adalah tentang logika perhitungan, dan dengan latihan yang konsisten, Anda pasti bisa menguasainya!
>





